Electrólisis: un pilar de la química moderna
La electrólisis es un proceso químico de vital importancia en la química y la tecnología moderna. A través de la aplicación de corriente eléctrica, la electrólisis induce reacciones químicas en una solución acuosa o fundida, lo que resulta en la separación de los componentes de esa solución en iones y su posterior redistribución en los electrodos. Este proceso tiene implicaciones significativas en una variedad de campos, desde la producción de metales hasta la purificación del agua. En este artículo, profundizaremos en cada aspecto relacionado con la electrólisis, comenzando con una comprensión básica de su funcionamiento y su importancia histórica, hasta sus aplicaciones prácticas en la actualidad.
¿Qué es la electrólisis?
La electrólisis es un proceso electroquímico en el que una corriente eléctrica se utiliza para inducir una reacción química en una solución acuosa o fundida. Esta corriente eléctrica causa que los iones presentes en la solución se muevan hacia los electrodos, donde se producen las reacciones químicas. Es importante destacar que la electrólisis solo puede ocurrir en soluciones que contienen electrolitos, es decir, sustancias que se disocian en iones cuando se disuelven en agua.
Durante la electrólisis, los iones positivos, llamados cationes, migran hacia el cátodo (el electrodo negativo), mientras que los iones negativos, llamados aniones, migran hacia el ánodo (el electrodo positivo). En los electrodos, los iones experimentan procesos de oxidación y reducción, lo que conduce a la formación de productos químicos nuevos.
Breve historia de la electrólisis
Los pioneros de la electrólisis
La historia de la electrólisis se remonta al siglo XVIII, cuando científicos como Luigi Galvani y Alessandro Volta realizaron experimentos pioneros que sentaron las bases para el desarrollo posterior de este proceso. Galvani, un médico y anatomista italiano, fue uno de los primeros en observar la relación entre la electricidad y los fenómenos biológicos. Sus experimentos con ranas muertas y la contracción muscular inducida por la electricidad fueron cruciales para el desarrollo del concepto de excitabilidad eléctrica en los tejidos animales.
Por otro lado, Alessandro Volta, un físico italiano, inventó la pila voltaica en 1800. Esta pila fue la primera fuente confiable de corriente eléctrica continua y permitió a los científicos generar electricidad de manera controlada para realizar experimentos. El trabajo de Volta marcó un hito en la comprensión y la aplicación de la electricidad en la química y la física.
Avances clave y descubrimientos
En el siglo XIX, la electrólisis experimentó avances significativos gracias al trabajo de científicos como William Nicholson, Anthony Carlisle, Humphry Davy y Michael Faraday. Nicholson y Carlisle fueron los primeros en realizar una electrólisis exitosa del agua en 1800, utilizando una pila voltaica para descomponer el agua en oxígeno e hidrógeno.
Humphry Davy, un químico británico, utilizó la electrólisis para aislar elementos químicos como el sodio, el potasio, el calcio y el magnesio a partir de sus compuestos. En 1807, Davy logró aislar el sodio y el potasio mediante electrólisis de sus sales fundidas, demostrando así la naturaleza elemental de estos metales alcalinos.
Michael Faraday, otro eminente científico británico, es considerado uno de los padres de la electroquímica moderna. En la década de 1830, Faraday formuló las leyes fundamentales que rigen la electrólisis, conocidas como las leyes de Faraday. Estas leyes establecen la relación cuantitativa entre la cantidad de electricidad que pasa a través de una celda electroquímica y la cantidad de productos químicos que se generan como resultado de la electrólisis.
Principios y proceso de la electrólisis
Fundamentos técnicos
La electrólisis se basa en el principio de la oxidación y la reducción, procesos químicos fundamentales en los que los electrones se transfieren entre especies químicas. En el ánodo, que es el electrodo positivo, ocurre la oxidación, donde los iones o moléculas pierden electrones y se convierten en especies químicas con una carga más positiva o neutra. Por otro lado, en el cátodo, que es el electrodo negativo, tiene lugar la reducción, donde los iones o moléculas ganan electrones y se convierten en especies químicas con una carga más negativa o neutra.
Las leyes de Faraday sobre la electrólisis
Las leyes de Faraday son dos principios fundamentales que describen la relación cuantitativa entre la cantidad de electricidad que pasa a través de una celda electroquímica y la cantidad de sustancias producidas en una electrólisis. La primera ley de Faraday establece que la cantidad de sustancia producida en una electrólisis es directamente proporcional a la cantidad de carga eléctrica que pasa a través del circuito. En otras palabras, cuanto mayor sea la corriente eléctrica que fluya a través de la celda electroquímica, mayor será la cantidad de productos químicos que se generarán como resultado de la electrólisis.
La segunda ley de Faraday establece que las cantidades de sustancias producidas en una electrólisis son proporcionales a sus equivalentes electroquímicos. Los equivalentes electroquímicos son una medida de la cantidad de sustancia que participa en una reacción química en función de su capacidad para ceder o ganar electrones. Por lo tanto, esta ley nos permite predecir cuántos gramos de una sustancia se producirán en una electrólisis en función de la cantidad de carga eléctrica que se utiliza y los equivalentes electroquímicos de las especies químicas involucradas.
Aplicaciones prácticas de la electrólisis
Electrometalurgia
Una de las aplicaciones más importantes de la electrólisis es en la electrometalurgia, donde se utiliza para la producción de metales a partir de sus compuestos. Un ejemplo destacado es la producción de aluminio mediante electrólisis de alúmina fundida en celdas de electrólisis de aluminio. En este proceso, la alúmina (óxido de aluminio) se disuelve en criolita fundida (fluoruro de aluminio) y se somete a electrólisis a alta temperatura. El aluminio líquido se deposita en el fondo de la celda, mientras que el oxígeno se libera en el ánodo.
Otro ejemplo es la producción de sodio mediante electrólisis de cloruro de sodio fundido en celdas de electrólisis de cloruro de sodio. En este proceso, el cloruro de sodio se disuelve en cloruro de calcio fundido y se somete a electrólisis a alta temperatura. El sodio metálico se deposita en el cátodo, mientras que el cloro gaseoso se libera en el ánodo.
Producción de hidrógeno
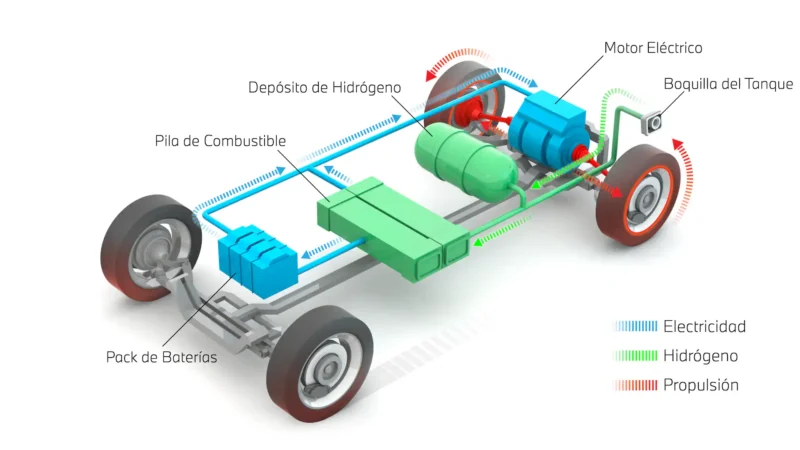
La electrólisis del agua es una técnica importante para la producción de hidrógeno, un combustible versátil que se puede utilizar en una variedad de aplicaciones, desde la generación de energía hasta el transporte. En la electrólisis del agua, se pasa corriente eléctrica a través de una solución acuosa de agua, lo que provoca la descomposición del agua en oxígeno e hidrógeno. El hidrógeno producido se puede utilizar como combustible en pilas de combustible para generar electricidad y propulsar vehículos eléctricos.
Tratamiento de agua
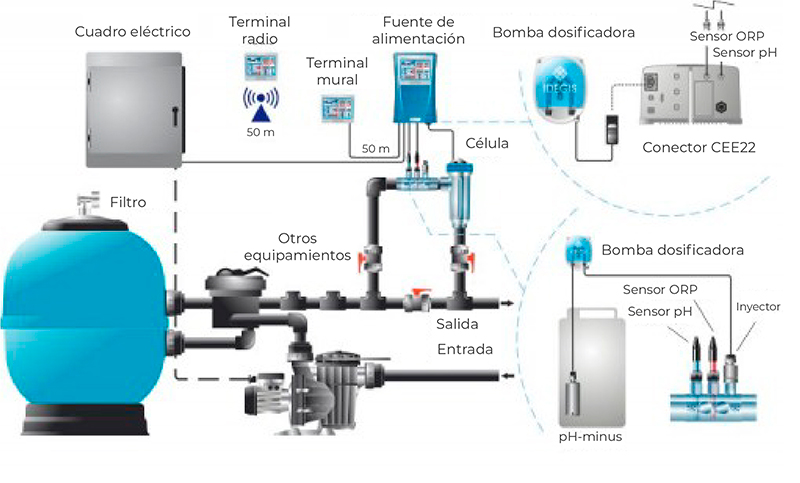
La electrólisis también se utiliza en el tratamiento de agua para la cloración de piscinas y la purificación de agua potable. En la cloración de piscinas, se utiliza una celda electroquímica para generar hipoclorito de sodio a partir de cloruro de sodio disuelto en agua. El hipoclorito de sodio es un desinfectante efectivo que mata las bacterias y los microorganismos presentes en el agua, manteniendo así la piscina limpia y segura para su uso.
En el caso de la purificación de agua potable, la electrólisis se puede utilizar para eliminar contaminantes orgánicos e inorgánicos del agua. Al pasar corriente eléctrica a través de una solución acuosa de agua, los contaminantes presentes en el agua se oxidan o reducen en los electrodos, lo que resulta en su eliminación o precipitación. Este proceso ayuda a garantizar que el agua potable cumpla con los estándares de calidad y sea segura para el consumo humano.
La electrólisis es un proceso químico que se utiliza para separar moléculas en sus elementos constituyentes mediante la aplicación de una corriente eléctrica. Este proceso tiene una gran cantidad de aplicaciones en la industria y el laboratorio, si deseas obtener más información sobre la electrólisis y su funcionamiento, te invito a visitar la página web de Todorenting.es



 910 054 321
910 054 321 info@todorenting.es
info@todorenting.es Facebook
Facebook Instagram
Instagram







